Đề thi học kì 2 môn Hóa học lớp 10 Kết nối tri thức
Mua tài khoản Hoatieu Pro để trải nghiệm website Hoatieu.vn KHÔNG quảng cáo & Tải nhanh File chỉ từ 99.000đ. Tìm hiểu thêm »
Đề thi học kì 2 lớp 10 môn Hóa sách Kết nối
Đề thi học kì 2 môn Hóa học lớp 10 Kết nối tri thức - Nhằm giúp các em có thêm tài liệu ôn tập cuối học kì 2 môn Hóa học lớp 10 bộ sách Kết nối tri thức. Trong bài viết này Hoatieu xin chia sẻ đến các em mẫu đề thi học kì 2 môn Hóa 10 KNTT có ma trận đề thi kèm theo gợi ý đáp án được các thầy cô giáo biên soạn theo đúng mạch kiến thức chương trình sách giáo khoa mới 2018.
1. Ma trận đề thi học kì 2 Hóa 10 KNTT
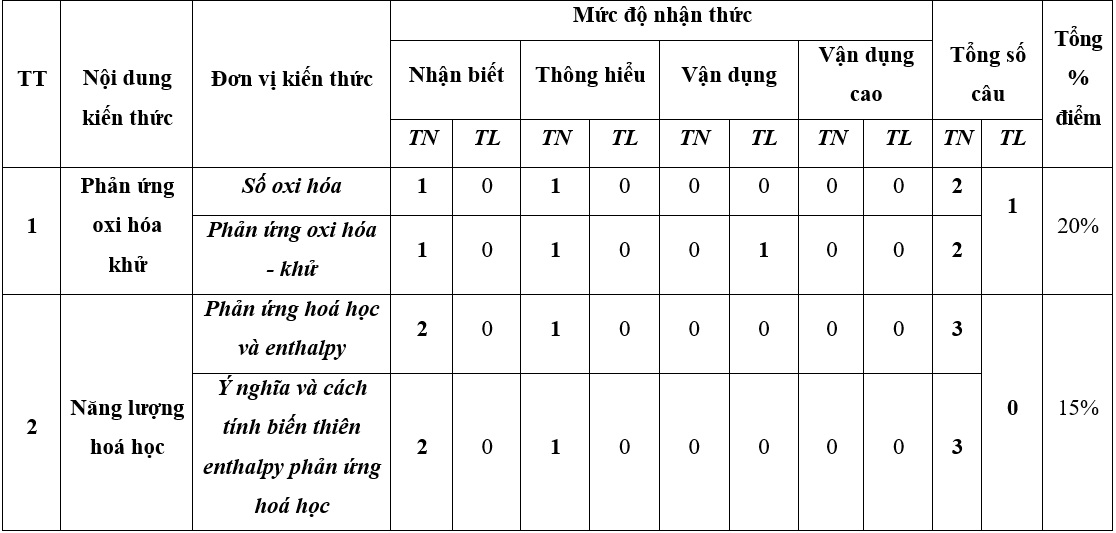
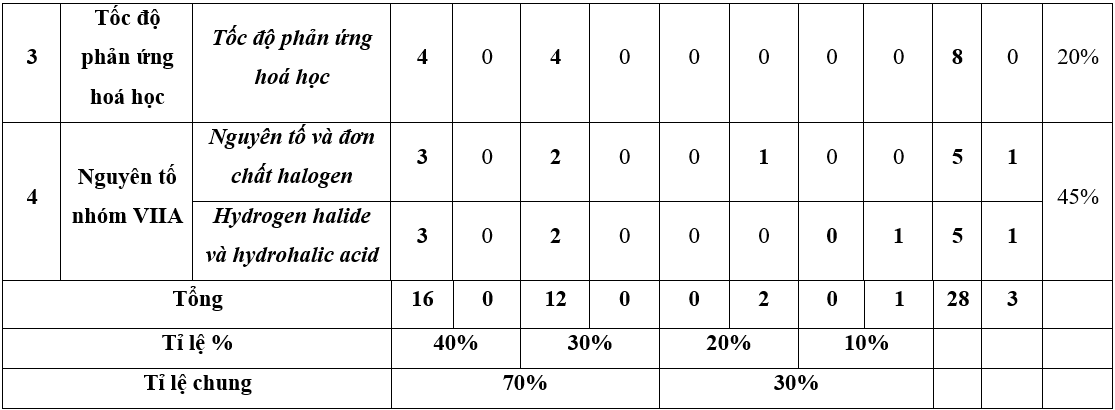
2. Đề thi Hóa học lớp 10 Kết nối tri thức học kì 2
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của Fe trong hợp chất Fe2O3 là
A. +2.
B. +3.
C. -2.
D. -3.
Câu 2: Hợp chất trong đó nitrogen có số oxi hoá -3 là
A. N2O.
B. KNO3.
C. N2O3.
D. NH4Cl.
Câu 3: Quá trình Ostwald dùng để sản xuất nitric acid từ ammonia được đề xuất vào năm 1902. Ở giai đoạn đầu của quá trình, ammonia bị oxi hoá bởi oxygen ở nhiệt độ cao khi có chất xúc tác:
4NH 3 + 5O 2  4NO + 6H 2 O
4NO + 6H 2 O
Chất bị oxi hoá trong quá trình trên là
A. NH3.
B. O2.
C. NO.
D. H2O.
Câu 4: Trong phản ứng oxi hoá – khử, chất khử là chất
- nhận electron.
- nhường proton.
- nhường electron.
- nhận neutron.
Câu 5: Phản ứng nào sau đây là phản ứng thu nhiệt?
- Phản ứng đốt cháy than trong không khí.
- Phản ứng tạo gỉ sắt.
- Phản ứng oxi hóa glucose trong cơ thể.
- Phản ứng trong lò nung clinker xi măng.
Câu 6: Phản ứng đốt cháy hoàn toàn 1 mol carbon graphite trong khí oxygen dư (ở điều kiện chuẩn) tạo ra 1 mol CO2, nhiệt lượng toả ra là 393,5 kJ. Nhiệt tạo thành chuẩn của CO2(g) là
- + 393,5 kJ/ mol.
- –393,5 kJ/ mol.
- +196,75 kJ/ mol.
- –196,75 kJ/ mol.
Câu 7: Enthalpy tạo thành chuẩn của một đơn chất bền là
A. biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với oxygen.
C. bằng 0.
D. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
Câu 8: Cho phương trình nhiệt hóa học của phản ứng:


Nhận xét nào sau đây là đúng?
- Phản ứng tỏa nhiệt mạnh.
- Phản ứng xảy ra thuận lợi ở điều kiện thường.
- Phản ứng xảy ra dưới điều kiện nhiệt độ thấp.
- Phản ứng thu nhiệt.
Câu 9: Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g)
Biến thiên enthalpy chuẩn của phản ứng được tính theo công thức là
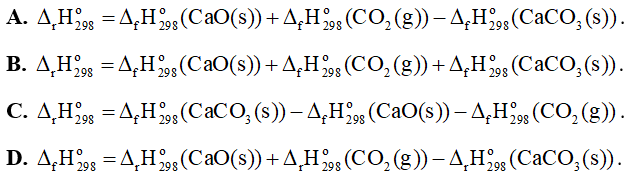
Câu 10: Cho phản ứng tạo thành propene từ propyne:

Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
C = C |
C ≡ C |
H - H |
|
Eb (kJ/mol) |
413 |
347 |
614 |
839 |
432 |
Biến thiên enthalpy chuẩn của phản ứng là
- -169 kJ.
- +169 kJ.
- -196 kJ.
- +196 kJ.
Câu 11: Sự thay đổi lượng chất trong khoảng thời gian vô cùng ngắn được gọi là
- tốc độ phản ứng hoá học.
- tốc độ trung bình của phản ứng.
- tốc độ tức thời của phản ứng.
- vận tốc trung bình của phản ứng.
Câu 12: Cho phương trình phản ứng tổng quát sau: 2A + B → C.
Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức:  .
.
Hằng số tốc độ k phụ thuộc vào yếu tố nào sau đây?
- Nồng độ của chất.
- Nồng độ của chất B.
- Nhiệt độ của phản ứng
- Thời gian xảy ra phản ứng.
Câu 13: Cho bột Fe vào dung dịch HCl loãng. Sau đó đun nóng hỗn hợp này. Phát biểu nào sau đây không đúng?
- Khí H2thoát ra nhanh hơn.
- Bột Fe tan nhanh hơn.
- Lượng muối thu được nhiều hơn.
- Nồng độ HCl giảm nhanh hơn.
Câu 14: Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 15: Hydrogen peroxide phân hủy theo phản ứng sau: 2H2O2 → 2H2O + O2.
Tại thời điểm ban đầu, thể tích khí oxygen là 0 cm3, sau thời gian 15 phút thể tích khí oxygen là 16 cm3. Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
- 1,067 M/ s.
- 1,067 M/ phút.
- 1,067 cm3/ s.
- 1,067 cm3/ phút.
Câu 16: Ở 35oC, phản ứng có tốc độ là 0,036 mol/ (L.h); ở 45oC, phản ứng có tốc độ là 0,09 mol/ (L.h). Hệ số nhiệt độ γ của phản ứng là
A. 1,5.
B. 2.
C. 2,5.
D. 3.
Câu 17: Cho phản ứng đơn giản sau (xảy ra trong bình kín):
2NO(g) + O2(g) → 2NO2(g)
Ở nhiệt độ không đổi, nồng độ NO tăng hai lần, nồng độ O2 không đổi thì
- tốc độ phản ứng không thay đổi.
- tốc độ phản ứng tăng 2 lần.
- tốc độ phản ứng tăng 4 lần.
- tốc độ phản ứng giảm 2 lần.
Câu 18: Nhận xét nào sau đây là sai?
- Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
- Với mọi phản ứng, khi tăng áp suất, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng.
- Đối với phản ứng có sự tham gia của chất khí, khi áp suất tăng, tốc độ phản ứng tăng.
Câu 19: Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố halogen thuộc nhóm
- IA
- IIA.
- VIIA.
- VIIIA.
Câu 20: Halogen nào được dùng trong sản xuất nhựa Teflon?
- Chlorine.
- Iodine.
- Fluorine.
- Bromine.
Câu 21: Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Bromine đóng vai trò
- chất khử.
- vừa là chất oxi hóa, vừa là chất khử.
- chất oxi hóa.
- không là chất oxi hóa, không là chất khử.
Câu 22: Cho các phản ứng hóa học sau, phản ứng nào chứng minh Cl2 có tính oxi hoá mạnh hơn Br2?
- Br2+ 2NaCl → 2NaBr + Cl2.
- Cl2+ 2NaOH → NaCl + NaClO + H2O.
- Br2+ 2NaOH → NaBr + NaBrO + H2O.
- Cl2+ 2NaBr → 2NaCl + Br2.
Câu 23: Phương trình hóa học nào sau đây viết sai?
- Br2+ Cu → CuBr2.
- 2HCl + Na2CO3→ 2NaCl + CO2 + H2O.
- NaBr + AgNO3→ AgBr + NaNO3.
- Cl2+ Fe → FeCl2.
Câu 24: Nguyên nhân dẫn tới nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen tăng từ fluorine đến iodine là do từ fluorine đến iodine,
- khối lượng phân tử và tương tác van der Walls đều tăng.
- tính phi kim giảm và tương tác van der Walls tăng.
- khối lượng phân tử tăng và tương tác van der Walls giảm.
- độ âm điện và tương tác van der Walls tăng giảm.
Câu 25: Phát biểu nào sau đây không đúng?
- Trong các hợp chất, ngoài số oxi hoá –1, fluorine còn có các số oxi hoá +1, +3, +5, +7.
- Muối AgI không tan trong nước, muối AgF tan trong nước.
- Fluorine có tính oxi hóa mạnh hơn chlorine.
- Dung dịch HF hòa tan được SiO2.
Câu 26: Cho lượng dư dung dịch AgNO3 tác dụng với 100 ml dung dịch hỗn hợp NaF 0,05M và NaCl 0,1M. Khối lượng kết tủa thu được là
- 1,345 gam.
- 3,345 gam.
- 2,875 gam.
- 1,435 gam.
Câu 27: Cho 10 gam CaCO3 tác dụng hết với dung dịch HCl dư, thu được V lít khí CO2 (đkc). Giá trị của V là
A. 2,24 L.
B. 2,479 L.
C. 3,36 L.
D. 3,719 L.
Câu 28: Nhỏ vài giọt dung dịch nào sau đây vào dung dịch AgNO3 thu được kết tủa màu vàng nhạt.
A. HCl.
B. NaBr.
C. NaCl.
D. HF.
Phần II: Tự luận
Câu 1 (1 điểm): Hãy viết phương trình hóa học để chứng minh chlorine có tính oxi hóa mạnh hơn bromine.
Câu 2 (1 điểm): Cho sodium iodide (NaI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4) thu được 3,02 gam manganese(II) sulfate (MnSO4), I2; K2SO4 và Na2SO4.
a) Viết phương trình hoá học xảy ra, chỉ rõ chất khử, chất oxi hoá, quá trình khử, quá trình oxi hoá.
b) Tính khối lượng I2tạo thành.
Câu 3 (1 điểm): Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau chứa trong các lọ riêng biệt mất nhãn: HCl, NaCl, NaI.
3. Đáp án đề kiểm tra học kì 2 môn Hóa học lớp 10 KNTT
Phần I: Trắc nghiệm
|
1 - B |
2 - D |
3 - A |
4 - C |
5 - D |
6 - B |
7 - C |
8 - D |
9 - A |
10 - A |
|
11 - C |
12 - C |
13 - C |
14 - B |
15 - D |
16 - C |
17 - C |
18 - B |
19 - C |
20 - C |
|
21 - C |
22 - D |
23 - D |
24 - A |
25 - A |
26 - D |
27 - B |
28 - B |
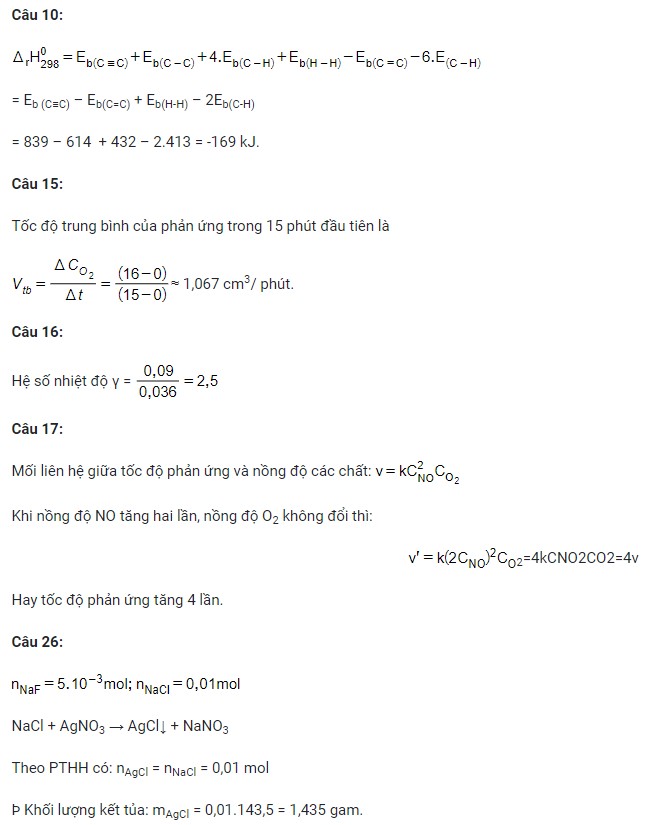

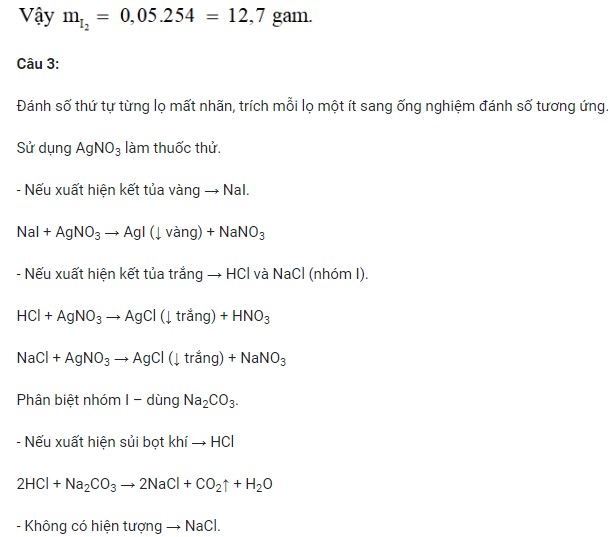
............................
Mời các bạn xem thêm đề thi học kì 2 môn Hóa 10 KNTT có đáp án trong file tải về.
Mời các bạn tham khảo thêm các thông tin hữu ích khác trong nhóm Lớp 10 thuộc chuyên mục Học tập của HoaTieu.vn.
-
Chia sẻ:
 Trần Thu Trang
Trần Thu Trang
- Ngày:
Đề thi học kì 2 môn Hóa học lớp 10 Kết nối tri thức
256,3 KB 18/04/2023 1:47:00 CHNhiều người quan tâm
Tham khảo thêm
-
Viết bài văn phân tích, đánh giá nét đặc sắc về nội dung hoặc nghệ thuật của một tác phẩm văn học mà em đã học
-
Đề kiểm tra cuối kì 2 Vật lý 10 Kết nối tri thức
-
(5 đề) Đề thi học kì 2 Vật lý 10 Chân trời sáng tạo 2024 có đáp án 2025
-
Phân tích Khoảng trời hố bom
-
Thực hành tiếng Việt lớp 10 trang 105 tập 2 Cánh Diều
-
Đề kiểm tra học kì 2 Công nghệ 10 Kết nối tri thức có đáp án
-
Viết bài văn nghị luận phân tích, đánh giá một tác phẩm văn học lớp 10 Cánh Diều
-
Đoạn văn Đừng để người thân bị tổn thương vì sự vô tâm của bạn
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Hướng dẫn & Hỗ trợ
Chọn một tùy chọn bên dưới để được giúp đỡ
-
Toán
- Giữa học kì 1
- Cuối học kì 1
-
Giữa học kì 2
- Đề thi giữa học kì 2 lớp 10 môn Toán trắc nghiệm
- Đề thi giữa kì 2 Toán 10 Chân trời sáng tạo
- Đề thi giữa kì 2 Toán 10 Kết nối tri thức
- Bộ đề thi giữa học kì 2 môn Toán lớp 10
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Cánh Diều
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Chân trời sáng tạo
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Kết nối tri thức
-
Cuối học kì 2
- Đề thi học kì 2 toán 10 Chân trời sáng tạo
- Đề thi cuối kì 2 Toán 10 Cánh Diều
- Đề thi cuối kì 2 Toán 10 Kết nối tri thức
- Top 10 đề thi cuối kì 2 Toán 10 Cánh Diều
- Bộ đề thi học kì 2 Toán 10 Chân trời sáng tạo
- Bộ đề thi cuối kì 2 Toán 10 Kết nối tri thức
- Bộ 5 đề kiểm tra học kì 2 Toán 10 Kết nối tri thức
- Bộ đề thi cuối học kì 2 Toán 10
- Đề thi học kì 2 Toán 10 Đồng Nai
- Đề thi học kì 2 Toán 10 Đà Nẵng
- Đề thi học kì 2 Toán 10 Bắc Ninh
- Đề thi học kì 2 Toán 10 TP.HCM
- Đề thi học kì 2 Toán 10 Phú Yên
- Đề cương ôn tập
- Ngữ văn
-
Lịch sử
- Giữa học kì 1
-
Cuối học kì 1
- Đề cương ôn tập học kì 1 môn Lịch sử 10 sách Kết nối tri thức 2025
- Đề cương ôn tập học kì 1 môn Lịch sử 10 sách Chân trời sáng tạo
- Đề thi học kì 1 môn Lịch sử lớp 10
- Đề thi học kì 1 Lịch sử 10 Kết nối tri thức
- Đề thi học kì 1 Lịch sử 10 Chân trời sáng tạo
- Đề kiểm tra học kì 1 Lịch sử 10 học sinh khuyết tật
- Giữa học kì 2
- Cuối học kì 2
- Đề cương ôn tập
- Địa lí
- Hóa học
- Vật lí
- Sinh học
- Công nghệ
- Tiếng Anh
- KTPL
- HĐTN
- Tin học
- HSG
Đề thi lớp 10 tải nhiều
-
Ma trận đề thi học kì 1 môn Giáo dục Kinh tế và Pháp luật 10 (CV 7991)
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 năm 2025 - 2026 (Sách mới)
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Cánh diều
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Chân trời sáng tạo
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Kết nối tri thức
-
Đề cương ôn tập học kì 1 Tin học 10 Cánh diều
-
Đề cương ôn thi cuối kì 1 Giáo dục Kinh tế và Pháp luật 10 Cánh diều
-
Đề cương ôn tập học kì 1 Tin học 10 Kết nối tri thức
-
Đề cương ôn tập học kì 1 môn Giáo dục Kinh tế và Pháp luật 10 (3 bộ sách)
-
Đề cương ôn thi cuối kì 1 Giáo dục Kinh tế và Pháp luật 10 Kết nối tri thức

Bài viết hay Đề thi lớp 10
-
Đề cương ôn tập giữa học kì 1 Tin học 10 Kết nối tri thức
-
Đề cương ôn tập giữa học kì 1 Vật lí 10 Cánh diều
-
Đề thi giữa học kì 2 môn Lịch sử 10 sách Kết nối tri thức
-
Bộ đề thi giữa học kì 1 Tiếng Anh 10 Global Success
-
Đề cương ôn tập học kì 1 Sinh học 10 Cánh diều
-
Đề thi giữa học kì 2 môn Công nghệ 10 sách Chân trời sáng tạo