Đề thi học kì 2 môn Hóa học lớp 10 Chân trời sáng tạo
Mua tài khoản Hoatieu Pro để trải nghiệm website Hoatieu.vn KHÔNG quảng cáo & Tải nhanh File chỉ từ 99.000đ. Tìm hiểu thêm »
Đề kiểm tra cuối kì 2 Hóa 10 CTST có đáp án
Đề thi học kì 2 môn Hóa học lớp 10 Chân trời sáng tạo được Hoatieu chia sẻ trong bài viết này bao gồm 2 mẫu đề thi học kì 2 môn Hóa học lớp 10 bộ sách Chân trời sáng tạo có ma trận đề thi và đáp án chi tiết sẽ là tài liệu ôn tập cuối kì 2 môn Hóa học 10 bổ ích cho các em học sinh. Sau đây là nội dung chi tiết đề kiểm tra cuối kì 2 Hóa 10 CTST có đáp án, mời các em cùng tham khảo.
1. Ma trận đề thi Hóa 10 học kì 2 Chân trời sáng tạo
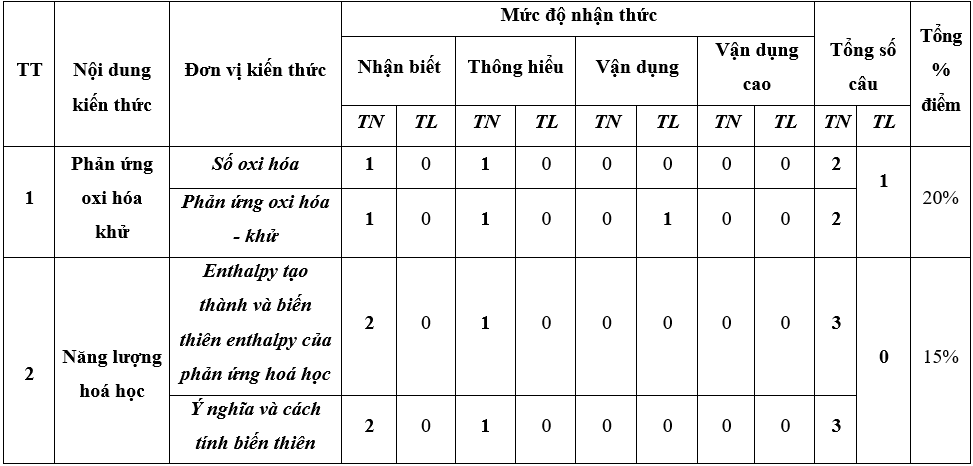
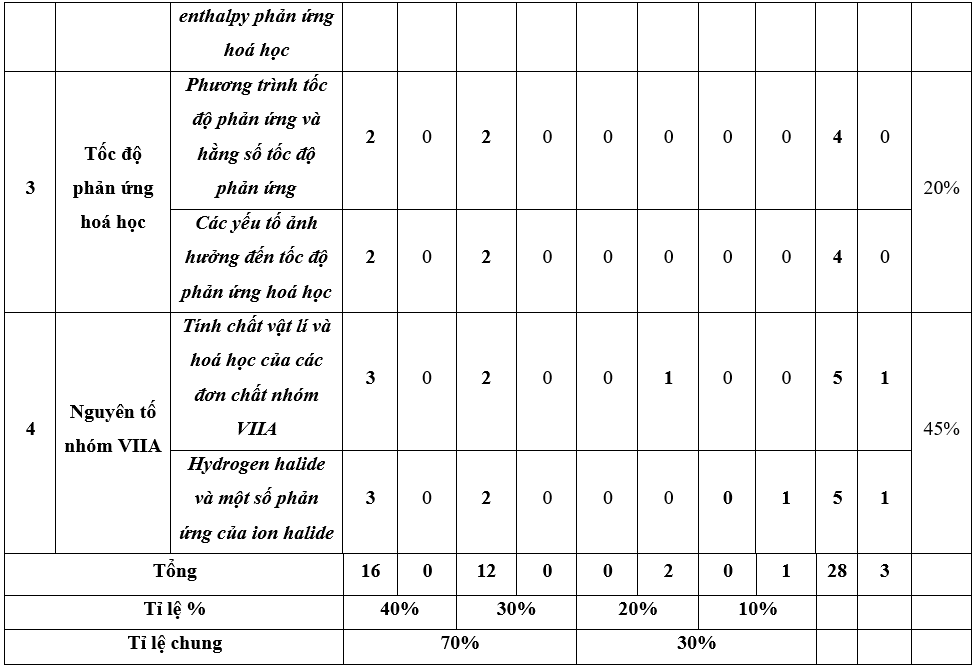
2. Đề thi học kì 2 môn Hóa 10 CTST 2023
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của sulfur trong hợp chất H2SO3 là
A. +2.
B. +4.
C. +6.
D. +8.
Câu 2: Cho các hợp chất sau: N2, N2O, NH3, HNO3, (NH4)2CO3. Số trường hợp trong đó nitrogen có số oxi hoá -3 là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 3: Cho các phản ứng hoá học sau:
(a) 2HCl + Fe → FeCl2 + H2.
(b) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
(c) HCl + KOH → KCl + H2O.
(d) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 4: Nguyên tử nitrogen chỉ thể hiện tính oxi hoá (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
A. N2.
B. NH3.
C. NO.
D. NaNO3.
Câu 5: Cho phương trình nhiệt hóa học của phản ứng:
C(s) + H2O(g) t∘→ CO(g) + H2(g) ΔrH0298=+131,25kJ
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. tỏa nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.
Câu 6: Dựa vào phương trình nhiệt hóa học của phản ứng sau:
CO (g) + ![]() \(\frac{1}{2}\)O2 (g) → CO2 (g) Δ r H 0 298 = − 283,00 kJ
\(\frac{1}{2}\)O2 (g) → CO2 (g) Δ r H 0 298 = − 283,00 kJ
Giá trị ΔrH0 298 của phản ứng 2CO(g) + O2(g) → 2CO2(g) là
- – 283 kJ.
- + 283 kJ.
- + 566 kJ.
- – 566 kJ.
Câu 7: Phản ứng nảo sau đây là phản ứng tỏa nhiệt?
- Phản ứng nhiệt phân thuốc tím (KMnO4).
- Phản ứng nhiệt phân Fe(OH)3.
- Phản ứng đốt cháy cồn (ethanol).
- Phản ứng nung NH4Cl(s) tạo ra NH3(g) và HCl(g).
Câu 8: Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
- 2C(than chì) + O2(g) → 2CO(g).
- C(than chì) + O(g) → CO(g).
- C(than chì) +
 \(\frac{1}{2}\)O2 (g) → CO(g)
\(\frac{1}{2}\)O2 (g) → CO(g) - C(than chì) + CO2(g) → 2CO(g).
Câu 9: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2 (g) (đỏ nâu) → N2O4 ( g ) (không màu)
Biết NO2 và N2O4 có ΔfH0298 tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. tỏa nhiệt, N2O4bền vững hơn NO2.
B. thu nhiệt, N2O4bền vững hơn NO2.
C. tỏa nhiệt, NO2bền vững hơn N2O4.
D. thu nhiệt, NO2bền vững hơn N2O4.
Câu 10: Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g) ΔrH0 298 = − 92 kJ
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
- 391 kJ/mol.
- 361 kJ/mol.
- 245 kJ/mol.
- 490 kJ/mol.
Câu 11: Tốc độ phản ứng viết theo định luật tác dụng khối lượng là
- tốc độ trung bình của phản ứng.
- tốc độ tức thời của phản ứng.
- tốc độ tính trung bình trong một khoảng thời gian phản ứng.
- tốc độ tính theo chất sản phẩm phản ứng.
Câu 12: Đối với phản ứng: A + 3B → 2 C, phát biểu nào sau đây đúng?
- Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo thành chất C.
- Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo thành chất C.
- Tốc độ tiêu hao chất B bằng 3 tốc độ tạo thành chất C.
- Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo thành chất C.
Câu 13: Phản ứng của H2 và I2 là phản ứng đơn giản: H2 (g) + I2 (g) → 2HI(g). Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là
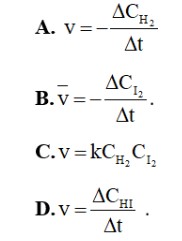
Câu 14: Tốc độ của một phản ứng hóa học lớn nhất khoảng thời điểm nào?
- Bắt đầu phản ứng.
- Khi phản ứng được một nửa lượng chất so với ban đầu.
- Gần cuối phản ứng.
- Không xác định được.
Câu 15: Yếu tố nào được sử dụng để tăng tốc độ phản ứng trong trường hợp sau: “Sự cháy diễn ra mạnh và nhanh hơn khi đưa lưu huỳnh (sulfur) đang cháy ngoài không khí vào lọ đựng khí oxygen”?
- Nồng độ.
- Áp suất.
- Nhiệt độ.
- A, B, C đều đúng.
Câu 16: Hệ số nhiệt độ Van’t Hoff được kí hiệu là
A. ∝.
B. γ.
C. φ.
D.θ.
Câu 17: Chất làm tăng tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là
- chất ức chế.
- chất xúc tác.
- chất hoạt hóa.
- chất điện li.
Câu 18: Cho ba mẫu đá vôi (không lẫn tạp chất) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
- t3< t2 < t1.
- t2< t1 < t3.
- t1< t2 < t3.
- t1= t2 = t3.
Câu 19: Trong dãy các halogen, khi đi từ fluorine đến iodine thì
A. bán kính nguyên tử giảm dần.
B. độ âm điện giảm dần.
khả năng oxi hoá tăng dần.
D. năng lượng liên kết trong phân tử đơn chất tăng dần.
Câu 20: Trong các tính chất sau, những tính chất nào không phải là chung cho các đơn chất halogen?
A. Phân tử gồm 2 nguyên tử.
B. Có số oxi hoá -1 trong hợp chất với kim loại và hydrogen.
C. Có tính oxi hoá.
D. Tác dụng mạnh với nước.
Câu 21: Trong số các hydrohalic acid dưới đây, chất có tính khử mạnh nhất là
A. HF.
B. HCl.
C. HBr.
D. HI.
Câu 22: Dung dịch nào dưới đây không tác dụng với dung dịch AgNO3?
A. NaF.
B. NaCl.
C. NaBr.
D. Na2SO4.
Câu 23: Để chứng minh Cl2 vừa có tính khử vừa có tính oxi hóa, người ta cho Cl2 tác dụng với
- dung dịch FeCl2.
- dây sắt nóng đỏ.
- dung dịch NaOH loãng.
- dung dịch KI.
Câu 24: Cấu hình electron lớp ngoài cùng của các ion halide (X-) là
A. ns2np4.
B. ns2np5.
C. ns2np6.
D. (n – 1)d10ns2np5.
Câu 25: Phản ứng nào sau đây là sai?
- 2F2+ 2H2O → 4HF + O2.
- Cl2+ H2O ⇄ HCl + HClO.
- Br2+ H2O ⇄ HBr + HBrO.
- F2+ H2O ⇄ HF + HFO.
Câu 26: Hydrogen halide có nhiệt độ sôi cao nhất là
- Hydrogen chloride.
- Hydrogen fluoride.
- Hydrogen bromide.
- Hydrogen iodide.
Câu 27: Rót 3 mL dung dịch HCl 1 M vào 2 mL dung dịch NaOH 1 M, cho quỳ tím vào dung dịch sau phản ứng, mẩu quỳ tím sẽ:
- hóa màu đỏ.
- hóa màu xanh.
- mất màu tím.
- không đổi màu.
Câu 28: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính khử.
(b) Hydrofluoric acid là acid yếu.
(c) Trong hợp chất, các halogen đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–.
Trong các phát biểu trên, số phát biểu sai là
A. 2.
B.4.
C. 3.
D.5.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Để điều chế khí chlorine (Cl2) trong phòng thí nghiệm, người ta thường cho potassium permanganate (KMnO4) tác dụng với hydrogen chloride (HCl):
KMnO 4 + HCl t∘→ KCl + MnCl2 + Cl2 + H2O
a) Lập phương trình hóa học của phản ứng hóa học trên bằng phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Giả sử lượng khí chlorine sinh ra phản ứng vừa đủ với dung dịch chứa 9,96 muối KX (X là một nguyên tố halogen) thu được 4,47 gam một muối duy nhất. Xác định công thức phân tử của muối KX.
Câu 2 (1 điểm): Hoàn thành các phương trình minh hoạ tính chất hoá học của các nguyên tố halogen:
a) Cl2+ Fe →
b) Cl2+ KOH →100∘C
c) Br2+ KI →
d) I2+ Al H 2 O →H2O
e) Ag + F2→
Câu 3 (1 điểm): Cho 2,9825 gam hỗn hợp A gồm: NaX, NaY (X, Y là hai halogen liên tiếp, nguyên tử khối của X nhỏ hơn của Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 0,7175 gam kết tủa. Xác định hai nguyên tố X, Y.
3. Đáp án đề thi học kì 2 Hóa 10 CTST
|
1 - B |
2 - C |
3 - A |
4 - D |
5 - A |
6 - D |
7 - C |
8 - C |
9 - A |
10 - A |
|
11 - B |
12 - A |
13 - C |
14 - D |
15 - A |
16 - B |
17 - B |
18 - C |
19 - B |
20 - D |
|
21 - D |
22 - A |
23 - C |
24 - C |
25 - D |
26 - B |
27 - A |
28 - A |


................................
Mời các bạn sử dụng file tải về để xem thêm đề thi học kì 2 môn Hóa lớp 10 CTST có đáp án.
Mời các bạn tham khảo thêm các thông tin hữu ích khác trong nhóm Lớp 10 thuộc chuyên mục Học tập của HoaTieu.vn.
-
Chia sẻ:
 Trần Thu Trang
Trần Thu Trang
- Ngày:
Đề thi học kì 2 môn Hóa học lớp 10 Chân trời sáng tạo
18/04/2023 2:30:00 CHNhiều người quan tâm
Tham khảo thêm
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Hướng dẫn & Hỗ trợ
Chọn một tùy chọn bên dưới để được giúp đỡ
-
Toán
- Giữa học kì 1
- Cuối học kì 1
-
Giữa học kì 2
- Đề thi giữa học kì 2 lớp 10 môn Toán trắc nghiệm
- Đề thi giữa kì 2 Toán 10 Chân trời sáng tạo
- Đề thi giữa kì 2 Toán 10 Kết nối tri thức
- Bộ đề thi giữa học kì 2 môn Toán lớp 10
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Cánh Diều
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Chân trời sáng tạo
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Kết nối tri thức
-
Cuối học kì 2
- Đề thi học kì 2 toán 10 Chân trời sáng tạo
- Đề thi cuối kì 2 Toán 10 Cánh Diều
- Đề thi cuối kì 2 Toán 10 Kết nối tri thức
- Top 10 đề thi cuối kì 2 Toán 10 Cánh Diều
- Bộ đề thi học kì 2 Toán 10 Chân trời sáng tạo
- Bộ đề thi cuối kì 2 Toán 10 Kết nối tri thức
- Bộ 5 đề kiểm tra học kì 2 Toán 10 Kết nối tri thức
- Bộ đề thi cuối học kì 2 Toán 10
- Đề thi học kì 2 Toán 10 Đồng Nai
- Đề thi học kì 2 Toán 10 Đà Nẵng
- Đề thi học kì 2 Toán 10 Bắc Ninh
- Đề thi học kì 2 Toán 10 TP.HCM
- Đề thi học kì 2 Toán 10 Phú Yên
- Đề cương ôn tập
- Ngữ văn
-
Lịch sử
- Giữa học kì 1
-
Cuối học kì 1
- Đề cương ôn tập học kì 1 môn Lịch sử 10 sách Kết nối tri thức 2025
- Đề cương ôn tập học kì 1 môn Lịch sử 10 sách Chân trời sáng tạo
- Đề thi học kì 1 môn Lịch sử lớp 10
- Đề thi học kì 1 Lịch sử 10 Kết nối tri thức
- Đề thi học kì 1 Lịch sử 10 Chân trời sáng tạo
- Đề kiểm tra học kì 1 Lịch sử 10 học sinh khuyết tật
- Giữa học kì 2
- Cuối học kì 2
- Đề cương ôn tập
- Địa lí
- Hóa học
- Vật lí
- Sinh học
- Công nghệ
- Tiếng Anh
- KTPL
- HĐTN
- Tin học
- HSG
Đề thi lớp 10 tải nhiều
-
Ma trận đề thi học kì 1 môn Giáo dục Kinh tế và Pháp luật 10 (CV 7991)
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 năm 2025 - 2026 (Sách mới)
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Cánh diều
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Chân trời sáng tạo
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Kết nối tri thức
-
Đề cương ôn tập học kì 1 Tin học 10 Cánh diều
-
Đề cương ôn thi cuối kì 1 Giáo dục Kinh tế và Pháp luật 10 Cánh diều
-
Đề cương ôn tập học kì 1 Tin học 10 Kết nối tri thức
-
Đề cương ôn tập học kì 1 môn Giáo dục Kinh tế và Pháp luật 10 (3 bộ sách)
-
Đề cương ôn thi cuối kì 1 Giáo dục Kinh tế và Pháp luật 10 Kết nối tri thức

Bài viết hay Đề thi lớp 10
-
Đề cương ôn tập giữa học kì 1 Địa lí 10 Cánh diều
-
Đề thi giữa kì 2 Văn 10 Chân trời sáng tạo 2024 (13 đề)
-
Bộ đề thi giữa học kì 1 Ngữ văn 10 Chân trời sáng tạo
-
Bộ đề thi giữa kì 1 tiếng Anh 10 Global Success Form 2025
-
Đề cương ôn tập Tiếng Anh lớp 10 học kì 2 có đáp án
-
Đề thi học kì 1 Sinh học 10 Chân trời sáng tạo (CV 7991)