Đề thi học kì 2 môn Hóa học lớp 10 Cánh Diều
Mua tài khoản Hoatieu Pro để trải nghiệm website Hoatieu.vn KHÔNG quảng cáo & Tải nhanh File chỉ từ 99.000đ. Tìm hiểu thêm »
Đề kiểm tra Hóa 10 học kì 2 Cánh Diều
Đề thi học kì 2 môn Hóa học lớp 10 Cánh Diều 2023 - Hoatieu xin chia sẻ đến các em học sinh mẫu đề kiểm tra học kì 2 môn Hóa học lớp 10 bộ sách Cánh Diều có ma trận đề thi và gợi ý đáp án chi tiết giúp các em ôn tập tốt môn Hóa. Sau đây là nội dung chi tiết đề trắc nghiệm Hóa học 10 học kì 2 năm học 2023 Cánh Diều, mời các em cùng tham khảo.
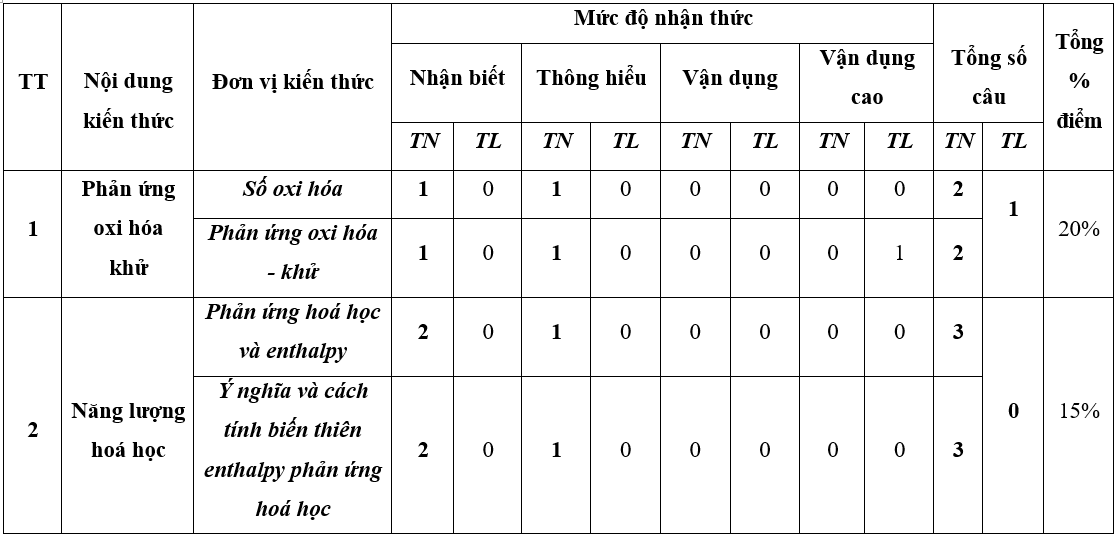
1. Ma trận đề thi Hóa học 10 kì 2 Cánh Diều

2. Đề thi cuối kì 2 môn Hóa học lớp 10 Cánh Diều
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của carbon trong hợp chất CO là
A. +1.
B. -1.
C. +2.
D. -2.
Câu 2: Cho các chất và ion sau: NH3; NO; Ca(NO3)2; NH4+; (NH4)2SO4; N2O3. Số trường hợp trong đó nitrogen có số oxi hoá -3 là
A. 4.
B. 1.
C. 2
D. 3
Câu 3: Cho các phát biểu sau:
(a). Sự oxi hoá là sự nhường electron hay sự làm tăng số oxi hoá.
(b). Trong quá trình oxi hoá, chất khử nhận electron.
(c). Sự khử là sự nhận electron hay là sự làm giảm số oxi hoá.
(d). Trong quá trình khử, chất oxi hoá nhường electron.
Số phát biểu đúng là
A. 4.
B. 1.
C. 2.
D. 3.
Câu 4: Cho phản ứng sau: 2Fe + 6H2SO4 →t° Fe2(SO4)3 + 3SO2 + 6H2O. Vai trò của H2SO4 trong phản ứng là
- chất khử.
- chất oxi hoá.
- chất tạo môi trường.
- vừa là chất oxi hoá, vừa là chất tạo môi trường phản ứng.
Câu 5: Cho các phản ứng hoá học sau:
(1) Phản ứng đốt cháy hydrogen: 2H2(g) + O2(g) → 2H2O(l).
(2) Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
Nhận xét nào sau đây là đúng?
- Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
- Cả hai phản ứng đều toả nhiệt.
- Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
- Cả hai phản ứng đều thu nhiệt.
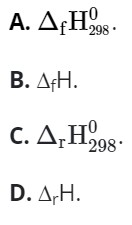
Câu 6: Enthalpy tạo thành chuẩn của một chất hoá học được kí hiệu là
Câu 7: Cho các phát biểu sau:
(a). Biến thiên enthalpy chuẩn của một phản ứng hoá học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25 oC.
(b). Nhiệt (toả ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c). Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
(d). Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
Số phát biểu đúng là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 8: Cho phản ứng sau:
2H2(g) + O2(g) → 2H2O(g) ∆rH0298=-483,64kJ
Enthalpy tạo thành chuẩn của H2O(g) là
- – 241,82 kJ/ mol.
- 241,82 kJ/ mol.
- – 483,64 kJ/ mol.
- 483,64 kJ/ mol.
Câu 9: Cho giản đồ năng lượng sau:
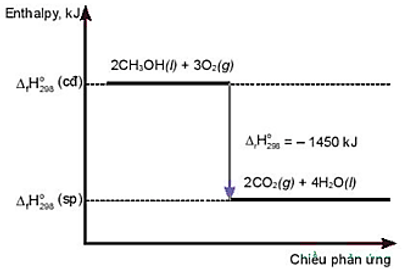
Phát biểu đúng là
- Phản ứng cần cung cấp nhiệt liên tục.
- Nhiệt lượng toả ra của phản ứng là 1450 kJ.
- Phản ứng thu nhiệt.
- Nhiệt lượng thu vào của phản ứng là – 1450 kJ.
Câu 10: Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
A. +158 kJ.
B. -158 kJ.
C. +185 kJ.
D. -185 kJ.
Câu 11: Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hoá học xảy ra, tốc độ phản ứng sẽ
- không đổi cho đến khi kết thúc.
- tăng dần cho đến khi kết thúc.
- chậm dần cho đến khi kết thúc.
- tuân theo định luật tác dụng khối lượng.
Câu 12: Cho phản ứng tổng quát sau:
aA + bB → mM + nN
Tốc độ trung bình của phản ứng tính theo chất A là
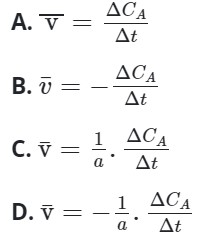
Câu 13: Cho phản ứng: 2CO(g) + O2(g) ⟶ 2CO2(g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 3 lần, các chất khác giữ nguyên nồng độ?
- Tăng gấp 3 lần.
- Tăng gấp 6 lần.
- Tăng gấp 9 lần.
- Giảm 3 lần.
Câu 14: Với phản ứng có γ = 2 γ=2 . Nếu nhiệt độ tăng từ 30°C lên 70°C thì tốc độ phản ứng
- tăng gấp 4 lần.
- tăng gấp 8 lần.
- giảm 4 lần.
- tăng gấp 16 lần.
Câu 15: Hằng số tốc độ phản ứng k
- phụ thuộc vào nhiệt độ và nồng độ chất phản ứng.
- phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
- chỉ phụ thuộc vào nồng độ chất phản ứng.
- chỉ phụ thuộc vào bản chất của chất phản ứng.
Câu 16: Chất làm tăng tốc độ phản ứng hóa học, nhưng không bị thay đổi về chất và lượng khi kết thúc phản ứng là
- chất xúc tác.
- chất ban đầu.
- chất sản phẩm.
- Cả A, B và C đều sai.
Câu 17: Hiện tượng nào dưới đây thể hiện ảnh hưởng của nhiệt độ đến tốc độ phản ứng?
- Thanh củi được chẻ nhỏ hơn thì sẽ cháy nhanh hơn.
- Quạt gió vào bếp than để thanh cháy nhanh hơn.
- Thức ăn lâu bị ôi thiu hơn khi để trong tủ lạnh.
- Các enzyme làm thúc đẩy các phản ứng sinh hóa trong cơ thể.
Câu 18: Thí nghiệm nghiên cứu tốc độ phản ứng giữa kẽm (zinc) với dung dịch hydrochloric acid của hai nhóm học sinh được mô tả bằng hình sau:
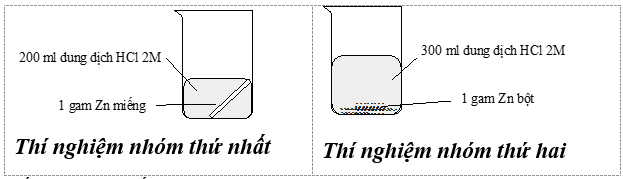
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
- nhóm thứ hai dùng axit nhiều hơn.
- diện tích bề mặt kẽm bột lớn hơn kẽm miếng.
- nồng độ kẽm bột lớn hơn.
- áp suất tiến hành thí nghiệm nhóm thứ hai cao hơn nhóm thứ nhất.
Câu 19: Cho các phát biểu sau về nguyên tử các nguyên tố nhóm VIIA:
(a). Có 7 electron hóa trị.
(b). Theo chiều tăng dần của điện tích hạt nhân nguyên tử thì độ âm điện giảm.
(c). Theo chiều tăng dần điện tích hạt nhân nguyên tử thì khả năng hút cặp electron liên kết giảm.
(d). Theo chiều tăng dần điện tích hạt nhân nguyên tử thì bán kính nguyên tử giảm.
Số phát biểu đúng là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 20: Khi phản ứng với các chất khác, nguyên tử halogen có xu hướng nào sau đây?
- Nhận thêm 1 electron từ nguyên tử khác.
- Góp chung electron hóa trị với nguyên tử nguyên tố khác.
- Nhường đi 7 electron ở lớp ngoài cùng.
- Cả A và B đều đúng.
Câu 21: Đặc điểm chung của các nguyên tố nhóm halogen là
- chất khí ở điều kiện thường.
- có tính oxi hóa mạnh.
- vừa có tính oxi hóa vừa có tính khử
- phản ứng mãnh liệt với nước.
Câu 22: Cho phản ứng X2 + 2NaBr(aq) → 2NaX(aq) + Br2. X có thể là chất nào sau đây?
A. Cl2.
B. I2.
C. F2.
D. O2.
Câu 23: Phản ứng nào dưới đây sai?
- 2Fe + 3Cl2 t∘ → 2FeCl3.
- H2 + I2 ⇄t°,Pt 2HI.
- Cl2 + H2O ⇄ HCl + HClO.
- F2 + H2O ⟶ HF + HFO.
Câu 24: Cho các phát biểu sau về ion halide X-:
(a). Dùng dung dịch silver nitrate sẽ phân biệt được các ion F-, Cl-, Br-, I-.
(b). Với sulfuric acid đặc, các ion Cl-, Br-, I- thể hiện tính khử, ion F- không thể hiện tính khử.
(c). Tính khử của các ion halide tăng theo dãy: Cl-, Br-, I-.
(d). Ion Cl- kết hợp ion Ag+ tạo AgCl là chất không tan, màu vàng.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 25: Dung dịch nước của chất nào sau đây được sử dụng để khắc các chi tiết lên thủy tinh?
A. HF.
B. HCl.
C. HBr.
D. HI.
Câu 26: Hòa tan 0,48 gam magnesium (Mg) trong dung dịch HCl dư. Sau phản ứng thu được thể tích khí H2 ở điều kiện chuẩn là
- 0,2479 lít.
- 0,4958 lít.
- 0,5678 lít.
- 1,487 lít.
Câu 27: Kim loại nào sau đây không tác dụng với dung dịch HCl?
A. Fe.
B. Na.
C. Ag.
D. Al.
Câu 28: Hydrogen halide có nhiệt độ sôi cao nhất là
A. HF.
B. HCl.
C. HBr.
D. HI.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Cho potassium iodide (KI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4), thu được 3,02 g manganese(II) sulfate (MnSO4), I2 và K2SO4.
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Tính khối lượng potassium iodide (KI) đã tham gia phản ứng.
Câu 2 (1 điểm): Cho một lượng khí Cl2 vừa đủ vào dung dịch chứa 7,14 muối KX (X là một nguyên tố halogen) thu được 4,47 gam một muối duy nhất. Xác định muối KX.
Câu 3 (1 điểm): Bằng phương pháp hoá học hãy phân biệt các chất sau: HBr; NaI; KCl chứa trong các lọ riêng biệt, mất nhãn.
3. Đáp án đề thi cuối kì 2 môn Hóa học lớp 10 Cánh Diều
|
1 - C |
2 - B |
3 - C |
4 - D |
5 - C |
6 - A |
7 - D |
8 - A |
9 - B |
10 - D |
|
11 - C |
12 - D |
13 - C |
14 - D |
15 - B |
16 - A |
17 - C |
18 - B |
19 - B |
20 - D |
|
21 - B |
22 - A |
23 - D |
24 - B |
25 - A |
26 - B |
27 - C |
28 - A |



+ Nếu có kết tủa vàng → NaI.
NaI + AgNO3 → AgI + NaNO3.
Mời các bạn tham khảo thêm các thông tin hữu ích khác trong nhóm Lớp 10 thuộc chuyên mục Học tập của HoaTieu.vn.
-
Chia sẻ:
 Trần Thu Trang
Trần Thu Trang
- Ngày:
Nhiều người quan tâm
Tham khảo thêm
-
Đề thi học kì 2 môn Hóa học lớp 10 Kết nối tri thức
-
Đề thi cuối kì 2 Tin học 10 Cánh Diều
-
Top 10 đề thi cuối kì 2 Toán 10 Cánh Diều
-
Soạn văn 10 Kết nối tri thức Con đường không chọn
-
Đề kiểm tra học kì 2 Công nghệ 10 Kết nối tri thức có đáp án
-
Bộ đề thi học kì 2 Toán 10 Chân trời sáng tạo
-
Viết báo cáo tìm hiểu về một ngành dịch vụ - Địa lí 10
-
Tự đánh giá Phép mầu kì diệu của văn học
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Hướng dẫn & Hỗ trợ
Chọn một tùy chọn bên dưới để được giúp đỡ
-
Toán
- Giữa học kì 1
- Cuối học kì 1
-
Giữa học kì 2
- Đề thi giữa học kì 2 lớp 10 môn Toán trắc nghiệm
- Đề thi giữa kì 2 Toán 10 Chân trời sáng tạo
- Đề thi giữa kì 2 Toán 10 Kết nối tri thức
- Bộ đề thi giữa học kì 2 môn Toán lớp 10
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Cánh Diều
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Chân trời sáng tạo
- Bộ đề kiểm tra giữa học kì 2 Toán 10 Kết nối tri thức
-
Cuối học kì 2
- Đề thi học kì 2 toán 10 Chân trời sáng tạo
- Đề thi cuối kì 2 Toán 10 Cánh Diều
- Đề thi cuối kì 2 Toán 10 Kết nối tri thức
- Top 10 đề thi cuối kì 2 Toán 10 Cánh Diều
- Bộ đề thi học kì 2 Toán 10 Chân trời sáng tạo
- Bộ đề thi cuối kì 2 Toán 10 Kết nối tri thức
- Bộ 5 đề kiểm tra học kì 2 Toán 10 Kết nối tri thức
- Bộ đề thi cuối học kì 2 Toán 10
- Đề thi học kì 2 Toán 10 Đồng Nai
- Đề thi học kì 2 Toán 10 Đà Nẵng
- Đề thi học kì 2 Toán 10 Bắc Ninh
- Đề thi học kì 2 Toán 10 TP.HCM
- Đề thi học kì 2 Toán 10 Phú Yên
- Đề cương ôn tập
- Ngữ văn
-
Lịch sử
- Giữa học kì 1
-
Cuối học kì 1
- Đề cương ôn tập học kì 1 môn Lịch sử 10 sách Kết nối tri thức 2025
- Đề cương ôn tập học kì 1 môn Lịch sử 10 sách Chân trời sáng tạo
- Đề thi học kì 1 môn Lịch sử lớp 10
- Đề thi học kì 1 Lịch sử 10 Kết nối tri thức
- Đề thi học kì 1 Lịch sử 10 Chân trời sáng tạo
- Đề kiểm tra học kì 1 Lịch sử 10 học sinh khuyết tật
- Giữa học kì 2
- Cuối học kì 2
- Đề cương ôn tập
- Địa lí
- Hóa học
- Vật lí
- Sinh học
- Công nghệ
- Tiếng Anh
- KTPL
- HĐTN
- Tin học
- HSG
Đề thi lớp 10 tải nhiều
-
Ma trận đề thi học kì 1 môn Giáo dục Kinh tế và Pháp luật 10 (CV 7991)
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 năm 2025 - 2026 (Sách mới)
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Cánh diều
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Chân trời sáng tạo
-
Bộ đề thi học kì 1 Giáo dục Kinh tế và Pháp luật 10 Kết nối tri thức
-
Đề cương ôn tập học kì 1 Tin học 10 Cánh diều
-
Đề cương ôn thi cuối kì 1 Giáo dục Kinh tế và Pháp luật 10 Cánh diều
-
Đề cương ôn tập học kì 1 Tin học 10 Kết nối tri thức
-
Đề cương ôn tập học kì 1 môn Giáo dục Kinh tế và Pháp luật 10 (3 bộ sách)
-
Đề cương ôn thi cuối kì 1 Giáo dục Kinh tế và Pháp luật 10 Kết nối tri thức

Bài viết hay Đề thi lớp 10
-
Đề cương ôn tập giữa học kì 1 Tin học 10 Kết nối tri thức
-
Đề cương ôn tập giữa học kì 1 Vật lí 10 Cánh diều
-
Đề thi giữa học kì 2 môn Lịch sử 10 sách Kết nối tri thức
-
Bộ đề thi giữa học kì 1 Tiếng Anh 10 Global Success
-
Đề cương ôn tập học kì 1 Sinh học 10 Cánh diều
-
Đề thi giữa học kì 2 môn Công nghệ 10 sách Chân trời sáng tạo